《Cell Stem Cell》:别再瞎等了,你的细胞需要“环境指令”!
2026年《Cell Stem Cell》重磅揭示:细胞命运并非“闭门造车”,而是由精确的“环境指令”编程。从胚胎着床到神经修复、免疫工程,微环境信号成为生命发育与再生的核心驱动力。

 |  |  |
你的细胞需要“环境指令”:颠覆性的《Cell Stem Cell》洞察

你是否曾认为,生命的奇迹,从最初的胚胎发育到复杂的神经修复,再到免疫系统的精妙运作,都是细胞本身“自带说明书,独立完成”的过程?如果是,那么2026年1月8日出版的《Cell Stem Cell》杂志,将彻底 颠覆你的认知。这期顶级刊物以一期之力,高调宣示:生命的演进与再生,远非细胞的“独角戏”,它更像是一场 细胞与微环境深度对话的协奏曲,其中“外部指令”和“精确编码”扮演着至关重要的角色。
这期杂志向我们揭示了一个全新的世界观:细胞的命运,并非仅由其内在基因决定,而是被其所处的 微环境中物理、化学和转录信号精确编程。细胞并非“想长成什么样就长成什么样”,而是环境在不断“告诉”它——“你需要这样生长!”今天,我们将深入解读这期杂志中的核心论文,特别是Song教授团队的封面文章,一窥他们如何 解锁人类胚胎着床的“黑匣子”,以及“环境指令”如何成为再生医学和发育生物学的新范式。
第一部分:封面故事——解锁人类胚胎植入的“黑匣子”
生命的起点,始于一个至今仍充满神秘色彩的阶段:人类胚胎着床。
你可曾想过,一个新生命诞生过程中,最神秘也最充满风险的第一步是什么?它并非精卵结合的那一刻,而是受精卵在母体子宫内 “扎根” 的过程。这个医学上称之为“着床”的阶段,发生在受精后的第7天到第14天,被科学家们形象地称为 “黑匣子时期”。之所以如此命名,是因为其过程隐秘,难以直接观察和研究。
在这个关键时期,胚胎需要经历剧烈的变化,不仅要与母体子宫内膜建立联系,还要迅速发育。然而,临床上绝大多数的妊娠失败,都恰恰发生在这个 “扎根期”。由于伦理和技术限制,科学家们一直苦于无法在实验室中真实重现这一过程。
直到Song教授团队发表了题为《3D Post-implantation co-culture of human embryo and endometrium》的 石破天惊研究,他们利用一个生理相关性极高的3D共培养平台,成功地“暴力解锁”了这个生命“黑匣子”。
1.1 从“孤家寡人”到“鱼水之欢”:跨越维度的技术飞跃
在Song团队之前,科学家们研究胚胎的方式相对简单——将其单独放置在培养皿中,或营养液里,让其独自发育至受精后约7天。这种 “孤家寡人” 式的培养,结果往往不尽如人意:胚胎形态扁平,发育迟缓,甚至关键的胎盘前体细胞(绒毛外滋养层细胞)分化也严重滞后。
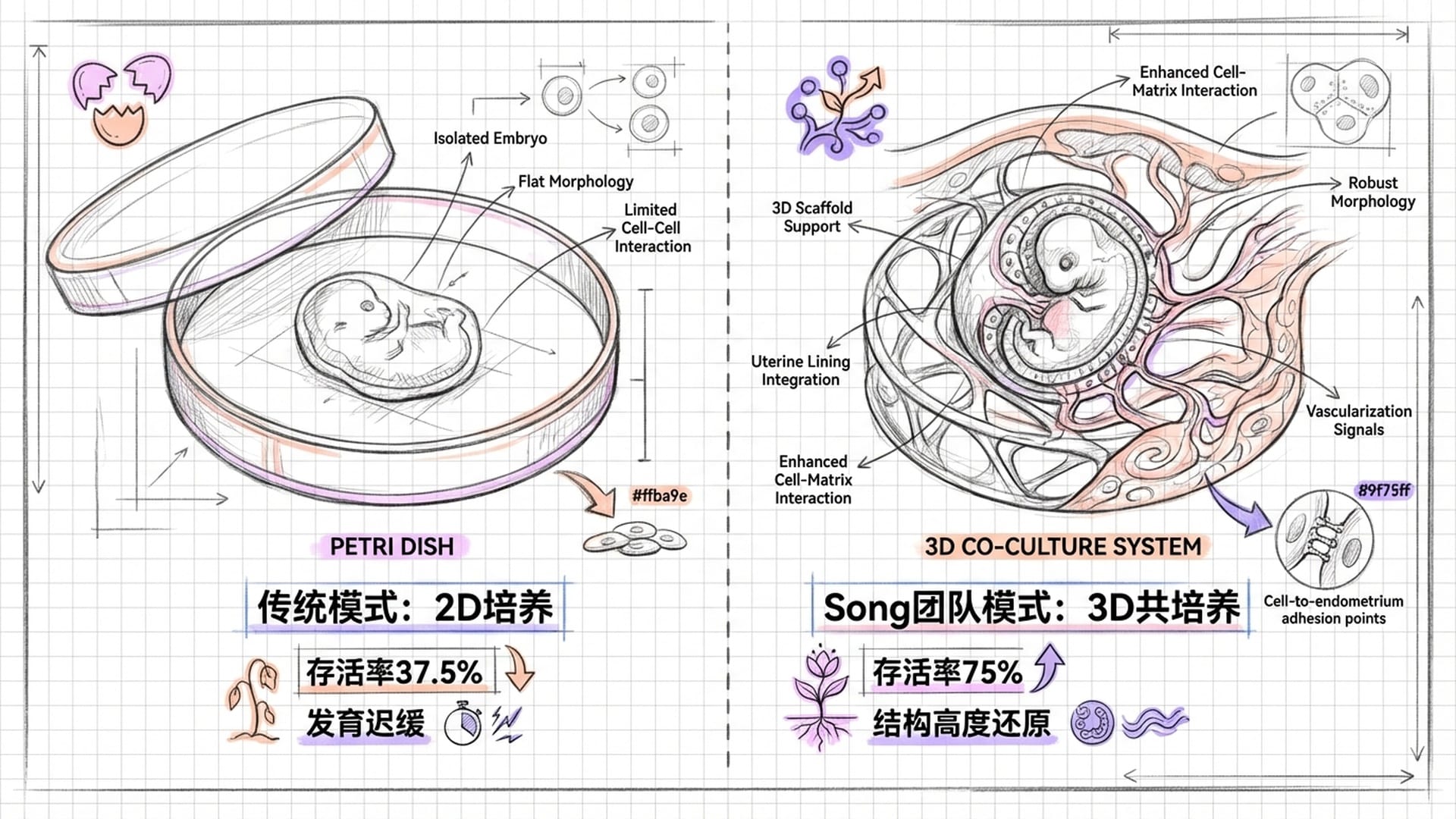
与此同时,虽然子宫内膜类器官(在培养皿中模拟子宫内膜的微结构)也能在实验室中建立,甚至能模拟激素周期,但胚胎和子宫内膜这两位生命的主角,在实验室中却始终处于 “老死不相往来” 的状态,各自为政。
Song团队的核心创新在于,他们成功地让这两位“佳偶”在体外 “重逢”,构建了一个整合的生态系统。他们首先优化了培养液,确保这两种细胞都能和谐生长,解决了共培养中常见的“营养不均”问题。更具突破性的是,他们引入了 三维支架技术。简单来说,就是为胚胎搭建了一个“小房子”,让它能够像在母体子宫中一样,植入到经过激素诱导、已做好“迎接生命”准备的子宫内膜类器官内部。
在这个创新的3D共培养系统中,研究人员观察到了前所未有的现象:
胚胎在受精后第5天被引入子宫内膜环境,第6天开始附着;第7天,胚胎如同一个微型钻头,突破子宫内膜上皮层,开始活跃地侵入;到了第9天,未来的羊水腔结构清晰可见,原始的卵黄囊也随之形成。 这些 高保真、时空同步 的发育过程,与真实人体内的发育模式高度一致,堪称教科书级别的还原!
为了更直观地展现这项技术的非凡之处,我们来看一组对比数据:在Song团队的3D共培养系统里,胚胎在第14天的存活率高达 75%,而传统单独培养仅为37.5%,足足翻了一倍!此外,3D共培养的胚胎直径在第14天能达到近700微米,与真实子宫内的胚胎大小相仿;而单独培养的胚胎仅有400多微米,矮了一大截。
这些数据强有力地证明:
母体组织的存在,绝非可有可无的背景板!它构成了胚胎正常发育所必需的 物理和生化支架。简而言之,母体子宫不仅仅是一个育儿袋,更是一个 智能化的“生长引导工厂”,它会主动通过“环境指令”告诉胚胎:“你应该这样生长,才能健康发育!”
1.2 子宫内膜对胚胎说:“孩子,该成熟了,去闯荡吧!”滋养层细胞的“加速”成熟与功能觉醒
这项研究最令人称奇的发现之一,就是子宫内膜这个微环境,对胚胎细胞分化展现出 “催化剂” 般的作用。在缺乏母体信号的单独培养中,那些日后将形成胎盘、负责“侵袭”子宫内膜的绒毛外滋养层细胞(EVT),出现得极晚,数量也稀少。然而,在Song团队的共培养体系中,这些EVT细胞在受精后 第9天就大量出现!这个时间点,比单独培养足足提前了3天!
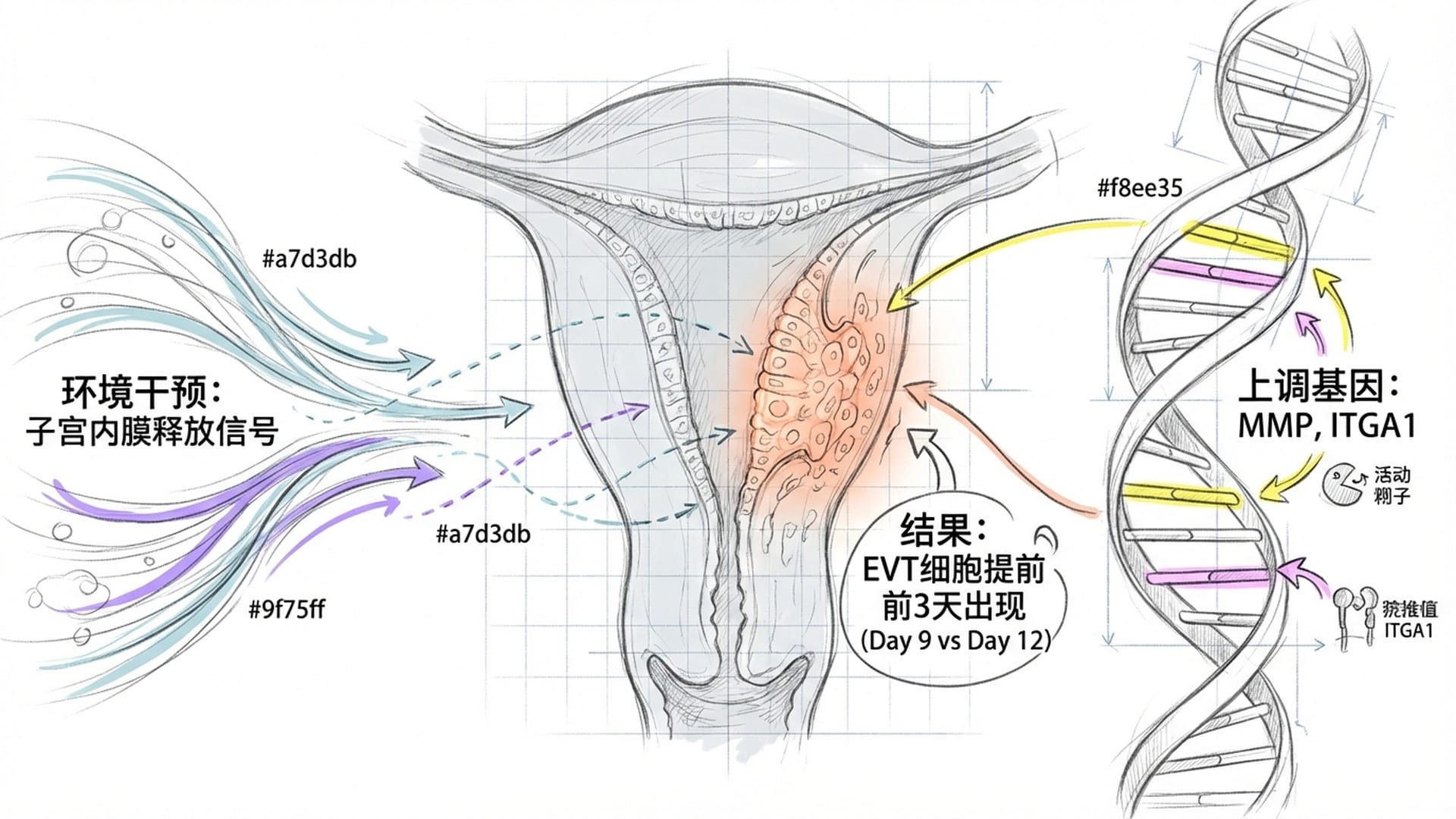
这表明,子宫内膜向胚胎传递了一个 “加速键”,使其更快地进入发育状态。通过单细胞转录组测序这一高科技手段,科学家们发现,在共培养环境下,EVT细胞显著上调了许多与 细胞侵袭和细胞外基质重塑 相关的基因。这意味着这些细胞变得更加 “善于攻击和改造” 周围环境,如同被激活的“建筑工人”,迅速投入到胎盘基础设施的搭建和改造之中。
这项发现更具颠覆性的启示是:
胚胎的侵袭能力,并非其自身“想侵袭就侵袭”的内在程序,而是由子宫内膜通过特定的分子信号 “解锁”并“加速” 的!子宫内膜宛如一位教练,对胚胎发出指令:*“现在是时候了,孩子,去冲刺吧!”*这种母胎间的 “神同步” 对于我们理解女性为何存在严格的“着床窗口期”至关重要。
1.3 分子握手:hCG-LHCGR信号轴的决定性作用
Song团队不仅展示了现象,更深入挖掘到了调控这场母胎对话的 “分子语言”。他们将目光聚焦于人绒毛膜促性腺激素(hCG)——俗称“怀孕激素”,及其受体LHCGR。研究表明,hCG主要由胚胎表面分泌,而LHCGR则高表达于子宫内膜类器官的上皮细胞上。
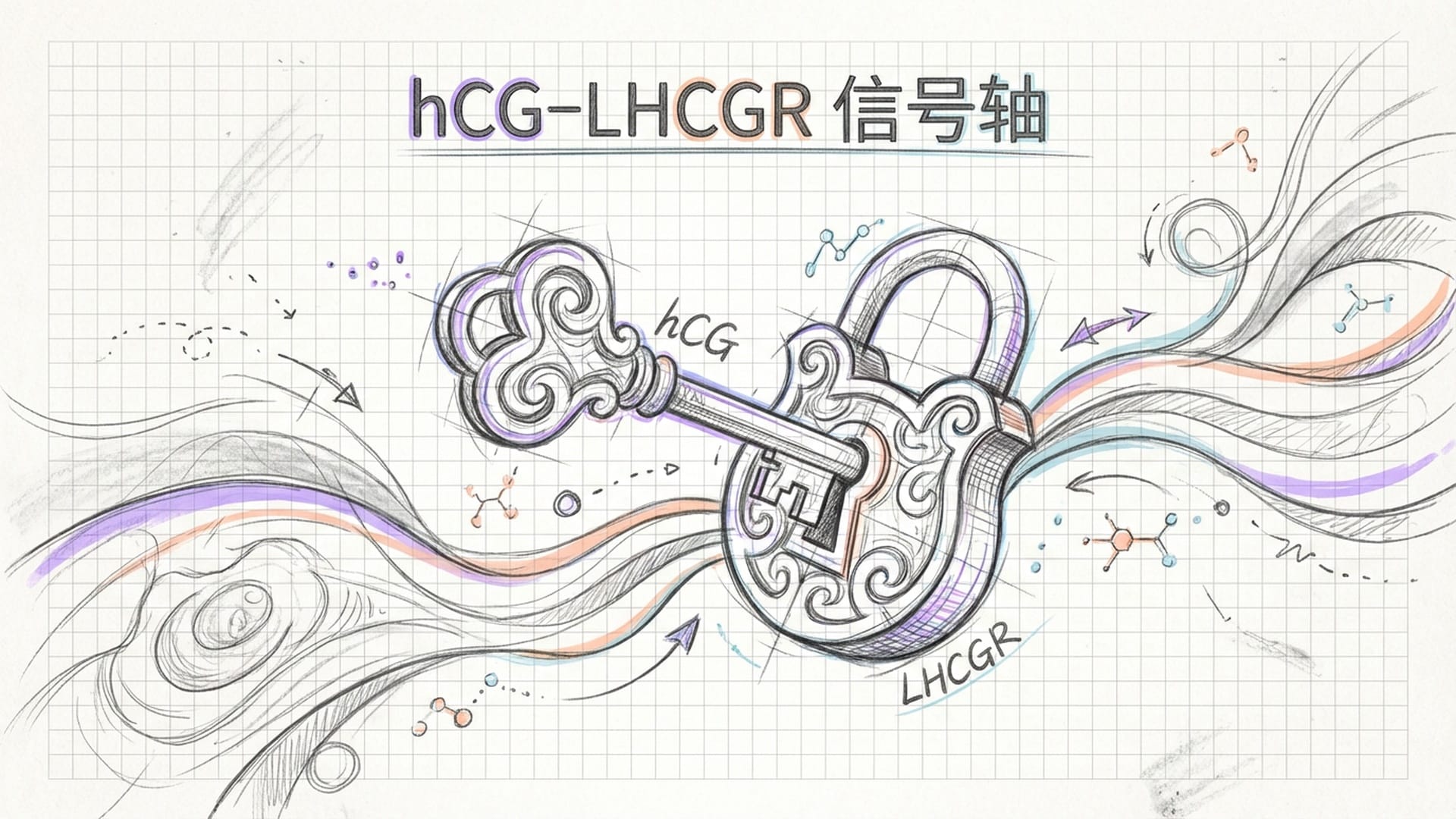
为了验证这对分子的功能,研究人员进行了一项“狠活儿”:用抗体中和hCG信号。结果令人震惊,在hCG信号被阻断的实验组中,胚胎在第6天的附着率 直接降至0%!要知道,对照组仍有50%的附着率。更令人不安的是,这些胚胎无一能发育超过9天。
这种“全有或全无”的效应,直接宣告了hCG作为着床 “通行证” 的至高地位。它不仅仅是一个被动的妊娠信号,更是启动子宫内膜接受性反应、介导物理黏附的 必需因子!它就像一块敲门砖,没有它,子宫这扇大门根本不会为胚胎敞开。
此外,研究团队还运用空间蛋白质组学技术,发现在胚胎与子宫内膜接触的界面上,一些名为 层粘连蛋白-整合素 的信号分子模块高度富集,它们如同紧紧相握的“双手”。这项研究,无疑为我们“直播”了人类胚胎着床的微观过程,解开了这一 千古谜题。
第二部分:重塑受损大脑——神经移植的“转录导航系统”
当Song团队揭示生命起点奥秘的同时,这期杂志的另一项重磅研究则为遭受毁灭性脑损伤的患者带来了 新的希望。这项由Wang和Zheng教授团队合作完成的研究,直击神经再生医学中的核心痛点:如何才能让移植的神经元不仅存活,还能 “找对路”、“连对线”?
2.1 从“添砖加瓦”到“重建电路”的挑战
中风是全球致残的头号杀手。中风后,大脑皮层神经元大量死亡,导致运动功能受损。尽管干细胞疗法一度被寄予厚望,但其在临床转化中遇到的最大难题是 “整合失败”。将神经前体细胞移植到受损大脑中,它们或许能通过分泌营养因子发挥辅助作用,但要真正修复断裂的神经回路,却 难如登天。
试想一下,如果移植的神经元不能像导航系统一样,精确地长出轴突并投射到脊髓或其他目标区域,那么恢复运动功能便是痴心妄想。更令人担忧的是,如果出现 “乱搭线” 的情况,甚至可能引发癫痫等严重副作用。如何实现神经回路的 精准重建,是摆在科学家面前的巨大挑战。
2.2 发现神经元的内置“GPS”:别再盲人摸象了!
Wang团队此次采用了相当巧妙的策略。他们将人类诱导多能干细胞(iPSC)分化出的皮层祖细胞,移植到中风小鼠的大脑运动皮层。随后,他们利用 病毒示踪技术和单细胞核RNA测序技术,如同为这些移植的神经元安装了“摄像头和麦克风”,跟踪它们的投射路径及其“基因悄悄话”(基因表达)。
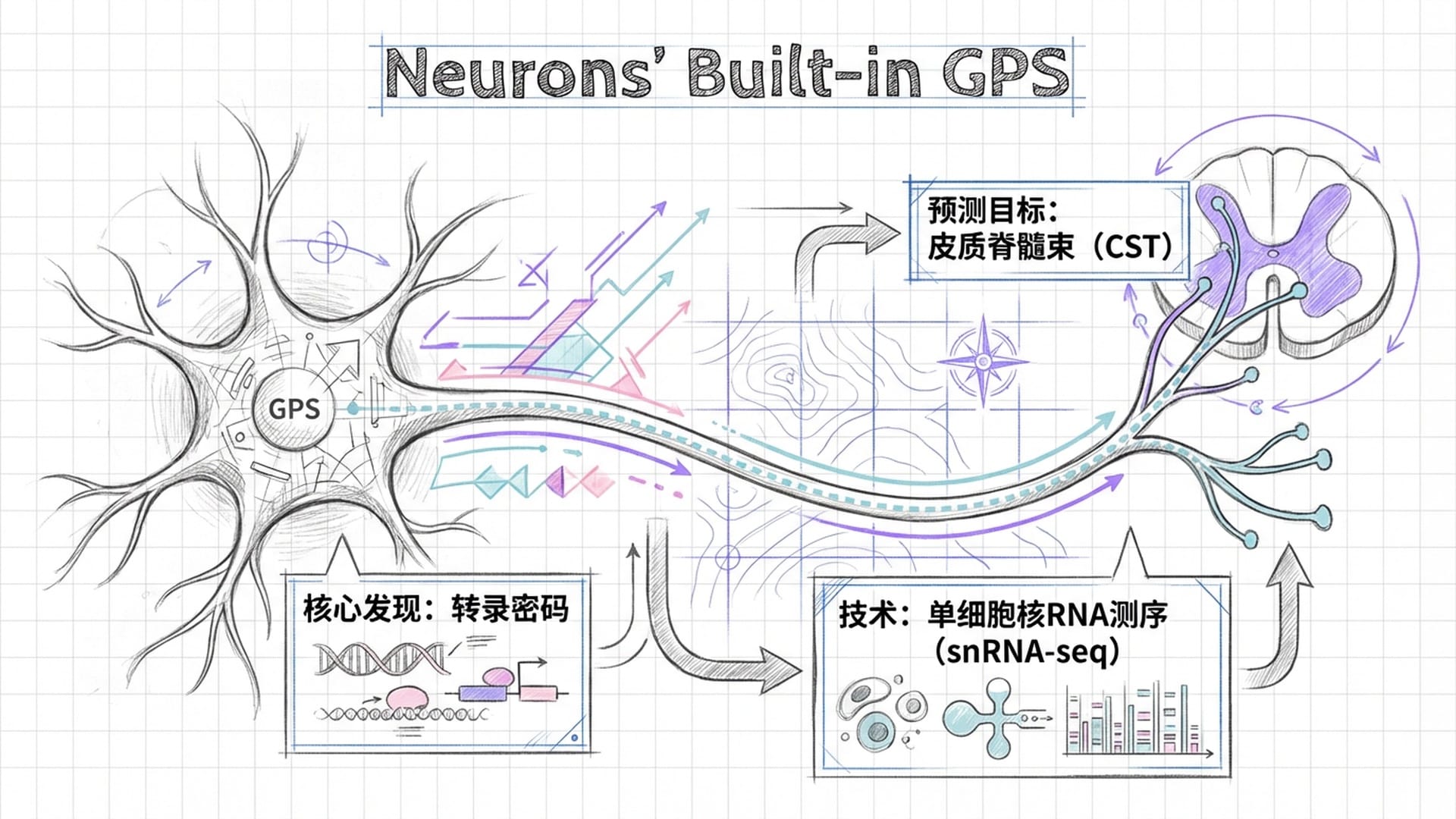
研究结果令人 大呼过瘾:这些移植的神经元并非毫无章法地乱长!相反,不同的神经元亚型表现出了与其 “基因身份”高度匹配的投射模式。研究团队成功识别出了一套 “转录密码”!
这套密码就像一个 内置的“GPS系统”!它由一组特殊的基因表达组合构成,尤其包含那些负责轴突导向和突触组装的关键基因。它能够精准预测一个神经元是否会将其轴突投射到皮质脊髓束,并最终连接到脊髓,从而恢复运动功能。
这无疑是 划时代的发现!它意味着我们找到了神经元自带的“导航系统”!只要能解读甚至改写这套转录密码,我们就有可能通过人工智能算法,筛选出那些最适合修复特定损伤通路的细胞亚型。例如,通过富集表达特定导航受体的神经元,我们能够显著提高移植细胞修复 皮质脊髓束 的效率,从而真正让中风瘫痪的患者 手脚重新动起来!
这项研究将神经细胞疗法从粗糙的“细胞填充”时代,直接推进到了 精准的“回路工程”时代。对于中风患者而言,这可能意味着未来的治疗不再是简单地注射干细胞,而是植入经过精密 “编程” 的神经元,它们携带着明确的指令,即使面对瘢痕组织,也能穿越并重建大脑与身体失联的通讯线路。
第三部分:定制免疫军队——T细胞工程的精准调控
除了胚胎着床和神经再生,这期《Cell Stem Cell》还在免疫治疗领域投下了一颗 重磅炸弹。由不列颠哥伦比亚大学的Jones和Salim团队完成的研究,成功攻克了合成免疫学中的一座“万里长城”:如何从多能干细胞中 高效诱导产生CD4+辅助性T细胞。
3.1 CAR-T疗法的“阿喀琉斯之踵”和“全能军队”梦想
CAR-T疗法在治疗恶性血液肿瘤方面取得了 惊人的效果,被誉为“抗癌神药”。然而,其巨大的缺点在于:昂贵且周期漫长!因为该疗法需要从患者自身提取T细胞进行基因改造,再回输。这不仅成本高达数十万美元,对于那些免疫系统已被癌症摧毁的患者来说,往往难以提取到数量和质量足够的T细胞。
因此,整个行业都在追逐一个 “通用型”梦想:能否从健康的供体或诱导多能干细胞中,大规模制备出可随时取用的CAR-T细胞,就像在超市购物般便捷?
然而,在体外诱导干细胞分化成T细胞的过程中,科学家们面临一个棘手的问题:制造出的T细胞,要么是 “战场刺客” CD8+杀伤性T细胞,要么是发育不成熟的细胞。而我们最渴望获得的、能 “发号施令” 的CD4+辅助性T细胞,却难以大量获得。
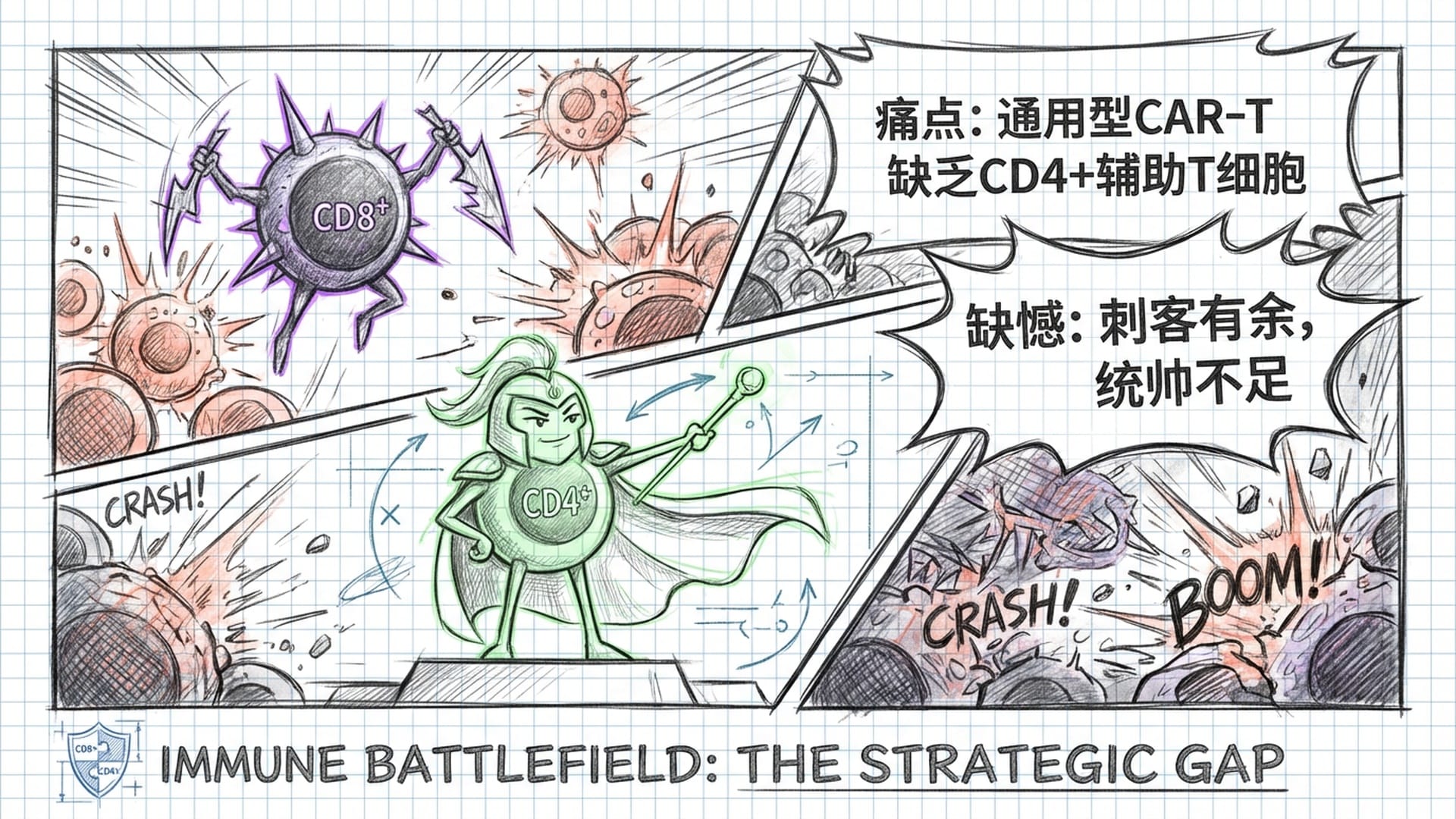
CD4+细胞在免疫反应中扮演着 “总司令” 的角色,它们分泌多种细胞因子,激活并维持CD8+细胞的杀伤力。如果CAR-T疗法中缺乏这些“总司令”,那么那些“刺客”可能会 后劲不足,很快“弹尽粮绝”,最终导致肿瘤复发。
3.2 Notch信号的时间艺术:“司令官”是如何炼成的
Jones和Salim团队的研究发现,问题的症结在于一个叫做 Notch信号通路 的精细“时间控制”。Notch信号是T细胞早期发育中的必经之路。然而,研究人员发现,如果Notch信号的持续时间过长,反而会抑制CD4+细胞的生成,将细胞推向CD8+的命运,甚至导致其“自杀”。
他们就像演奏家般,精确地调节Notch信号的强度和持续时间。结果,奇迹发生了!他们发现,在 特定的时间窗口“撤掉”Notch信号,就能让那些处于前体阶段的CD4+CD8+双阳性细胞,顺利转化为 功能成熟的CD4+辅助T细胞!
这些在体外制造出的“总司令”,不仅形态上与体内真实细胞相似,其功能也 丝毫不逊色。它们能进一步分化成各种亚型,并在被激活后分泌相应的细胞因子。
这项技术的突破意义非凡:
意味着未来的 “通用型”免疫疗法,将不再是单一的“刺客部队”,而是一个包含 “总司令”的完整合成免疫军队!这将极大地提升抗肿瘤治疗的效力、持久性和广谱性,为癌症患者带来更经济、更有效的治疗选择。
第四部分:综合洞察——走向“指令式”生物工程
纵观2026年1月这期《Cell Stem Cell》杂志,一个清晰的趋势浮出水面:生物医学研究正经历一场从 “被动观察”到“主动环境和指令工程” 的范式转移。
1. 细胞没有“默认”发育模式
这三项研究不约而同地告诉我们:细胞在体外培养时,根本没有所谓的 “正确”生长路径。
- 例如,在缺乏子宫内膜物理和化学指令的环境下,胚胎的滋养层发育会 迟缓且不完整。胚胎并非天生就知道该如何生长。
- 再如,移植的神经元,如果没有特定的转录编码,就像一个 “盲人”,根本无法找到回家的路,完成功能性的连接。
- 还有T细胞,如果没有精准的时间信号控制,干细胞就无法分化出关键的辅助T细胞亚群,从而无法形成一个 完整的免疫军团。
2. 微环境是可以编程的“药物”
未来的治疗,可能不再仅仅是简单地向患者注射细胞,而是给予 “细胞+环境”,或者 “细胞+指令” 的组合疗法。
- 对于反复着床失败的女性,治疗策略可能不再只关注胚胎本身,而是要 修正子宫内膜的信号环境,例如调节那些接收胚胎信号的受体。
- 对于中风患者,治疗产品将不仅仅是神经干细胞,而是那些经过基因编辑,携带 特定导航受体的“智能神经元”,它们如同被预装了导航地图的细胞,能够精准抵达目标。
3. 临床转化的新路径
在生殖医学领域,Song团队的共培养系统为筛选更好的胚胎培养液提供了 高通量平台。未来,我们或许能开发出一种新型的试管婴儿培养液,其中富含模拟母体子宫内膜的各种信号因子,以 大幅提高怀孕成功率。最重要的是,这个模型首次使我们能够在体外研究 人类早期流产的动态过程。胚胎在子宫内膜中的周期性“收缩-扩张”运动,甚至可能成为预测胚胎活力的 无创生物标志物!
结语:超越培养皿的生命科学
Song团队的3D胚胎-子宫内膜共培养系统,无疑是生物工程学上的一次 历史性胜利。它不仅填补了我们对人类发育早期阶段认知的空白,更为我们理解人类生命最初两周提供了一个 高保真的窗口。当这扇窗被推开,我们所看到的不再是静态的组织切片,而是一个充满 动态交互、信号握手和环境指令 的复杂生态系统。
与此同时,Wang团队和Jones团队的工作也深刻提醒我们,无论是修复受损的大脑,还是武装我们的免疫系统,成功的关键都在于 破译和重写细胞与环境之间的对话密码。随着合成生物学与再生医学的深度融合,我们正一步步掌握生命的底层代码——让胚胎着床更安全,让受损神经重新连接,让免疫细胞精准杀敌。
站在2026年的开端,这些研究不仅仅是学术期刊上的铅字,更是无数患者 未来的希望蓝图。正如这期杂志所展示的,生命科学的下一个飞跃,就在于我们能否在培养皿中,精准地重建那个孕育生命、修复创伤的 “神圣微环境”。
 |  |  |