重读CRISPR:不动刀,也能改写生命剧本?
悉尼新南威尔士大学与圣犹大儿童研究医院在《自然通讯》发表新发现,揭示第三代CRISPR技术——表观遗传编辑,无需切割DNA,通过移除或添加甲基基团来“开关”基因,为镰状细胞病等遗传疾病带来更安全且精准的治疗新希望。
 |  |  |  |
SOURCE LINK
重读CRISPR:不动刀,也能改写生命剧本?
你是否曾想过,有一种科技能够精确地编辑你的基因,从而改写生命的剧本?过去,我们所知的基因编辑技术,往往像是外科手术,精准而有力,但也伴随着不可预知的风险。然而,随着科技的飞速发展,一场“温柔的革命”正在基因治疗领域悄然兴起。一个全新的时代已经到来,它承诺在不动“刀”的前提下,就能精准调控基因,这听起来是否有些科幻?
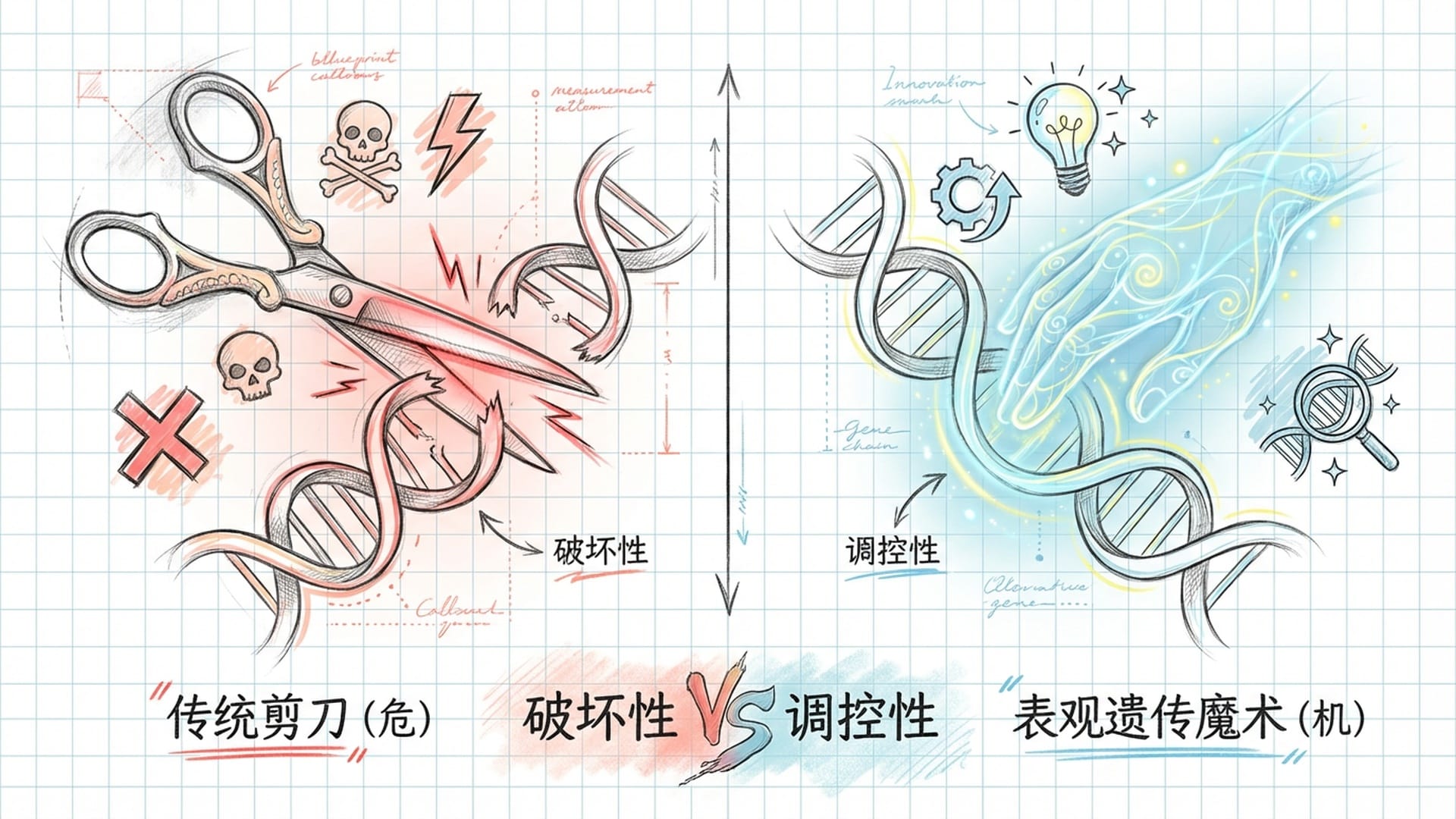
传统基因编辑技术常常被比作一把“剪刀”,将有缺陷的基因片段剪除,再替换为健康的基因。这种方式虽然有效,却也潜藏着**“剪错”或“留下毛边”的风险**,可能导致新的健康问题,甚至是癌症。面对需要长期治疗的遗传疾病,这种“切割”的风险无疑让人望而却步。
🔬 科学新突破:表观遗传编辑的黎明
近期,悉尼新南威尔士大学与圣犹大儿童研究医院的科学家们联手,在《自然通讯》杂志上发表了一项突破性研究,为我们描绘了基因编辑的全新图景。他们推出了一种名为“表观遗传编辑”的CRISPR新技术,其核心理念在于不动DNA的根基,仅在基因的**“表面”进行“微调”,便能唤醒沉睡的基因**,或让活跃的基因安静下来。
这种新的CRISPR技术,就好比我们找到了一个基因遥控器,无需拆卸更换,轻轻一按,就能精准地“开关”基因,而且不会损坏任何“电路”。
长期以来,科学家们对DNA上**“甲基基团”**的角色争论不休。这些小小的化学标签,究竟只是基因不活跃的标识,还是主动“关闭”基因的元凶?新南威尔士大学副校长兼该研究首席作者墨林·克罗斯利教授,用一个形象的比喻终结了这场争论:
“我们非常清楚地证明,如果你把基因上的**‘蜘蛛网’刷掉**,这个基因就会重新启动。当我们把这些甲基基团重新加回到基因上时,它们又被关掉。所以你看,这些化合物可不是什么蜘蛛网,它们是实实在在的**‘锚点’,把基因牢牢地锚定住了**。”
这彻底颠覆了我们对DNA甲基化的传统认知,证明了它不仅是基因抑制的**“伴随物”,更是其“主谋”**。
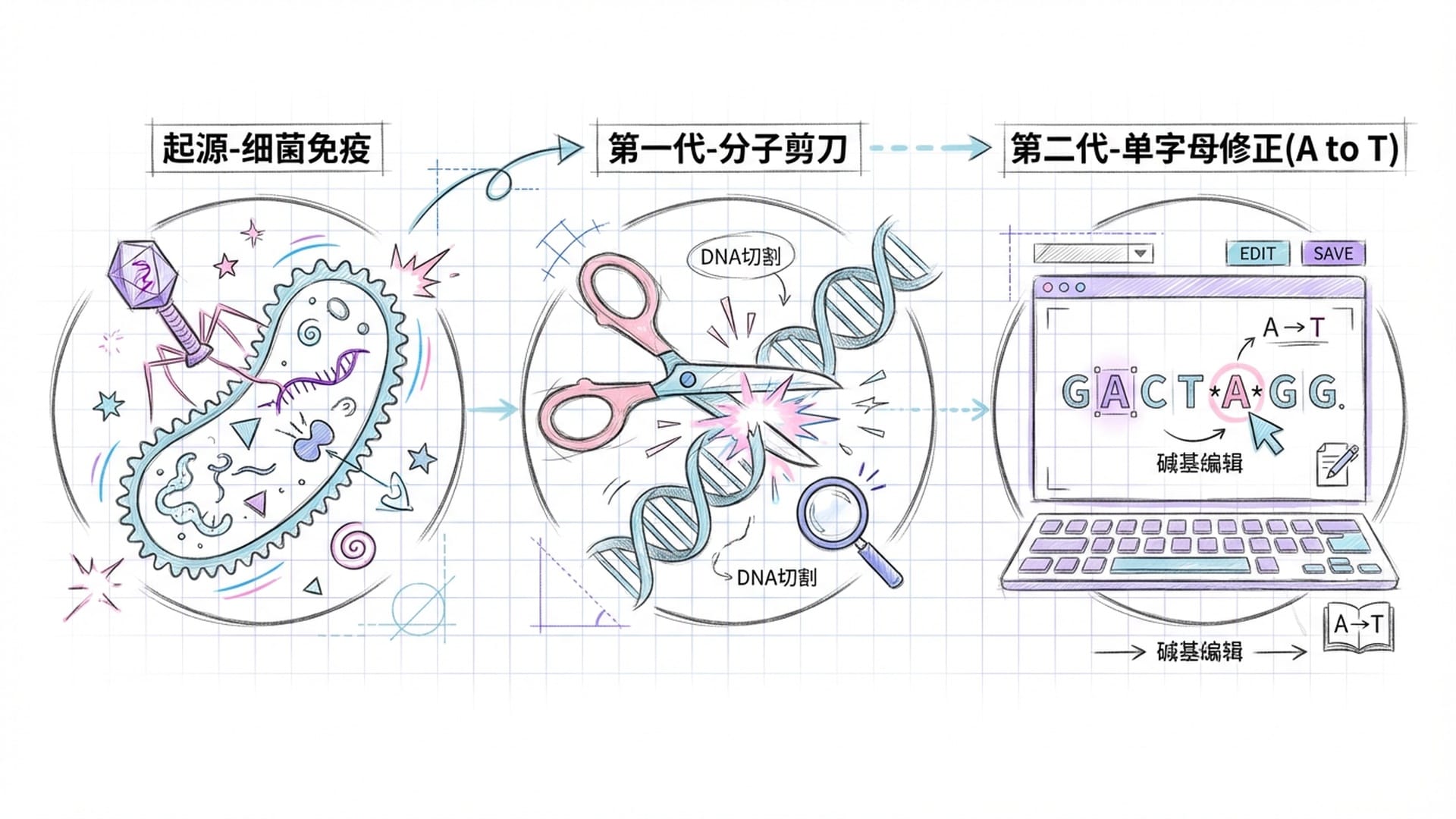
🧬 CRISPR进化史:从“剪刀”到“清洁工”
CRISPR的全称是“成簇的规律间隔的短回文重复序列”,最初在细菌中被发现,是细菌抵御病毒入侵的防御机制。它能像一把“剪刀”,精准切断入侵者的DNA。
第一代CRISPR技术借鉴了细菌的这种“剪DNA”行为,能够直接删除有缺陷的基因片段。而第二代CRISPR则更进一步,能像文字处理软件一样,对基因进行**“单字母修正”。然而,无论是哪一代,其“切割”DNA的本质都带来了脱靶效应和诱发癌症**等潜在风险。
“‘每次你切割DNA,就有得癌症的风险。如果你是在为一种需要终身治疗的疾病做基因治疗,这种风险更是糟糕透顶。’这是克罗斯利教授对传统CRISPR潜在风险的警示。”
现在,第三代CRISPR,即“表观遗传编辑”,则开启了无创基因调控的新范式。它不再对DNA链进行切割,而是引入了一种特殊“酶”,如同基因的“清洁工”,专门清除DNA上的甲基基团,从而**“松绑”被压制或沉默的基因**,使其重新活跃。
🌟 镰状细胞病的福音:唤醒“备用方案”
这种温和的表观遗传编辑技术,为众多遗传病患者带来了新的希望,尤其是对镰状细胞病的治疗。镰状细胞病是一种红细胞异常的遗传性疾病,严重影响患者的生活质量。
研究人员巧妙地将目光投向了人体自身的“备用方案”——胎儿血红蛋白基因。这个基因在胎儿时期负责氧气输送,但在出生后便会“关闭”。对于成人血红蛋白基因有缺陷的镰状细胞病患者来说,如果能通过表观遗传编辑技术,重新“打开”胎儿血红蛋白基因,让它继续工作,便能有效替代有缺陷的成人血红蛋白,从而绕过病灶。
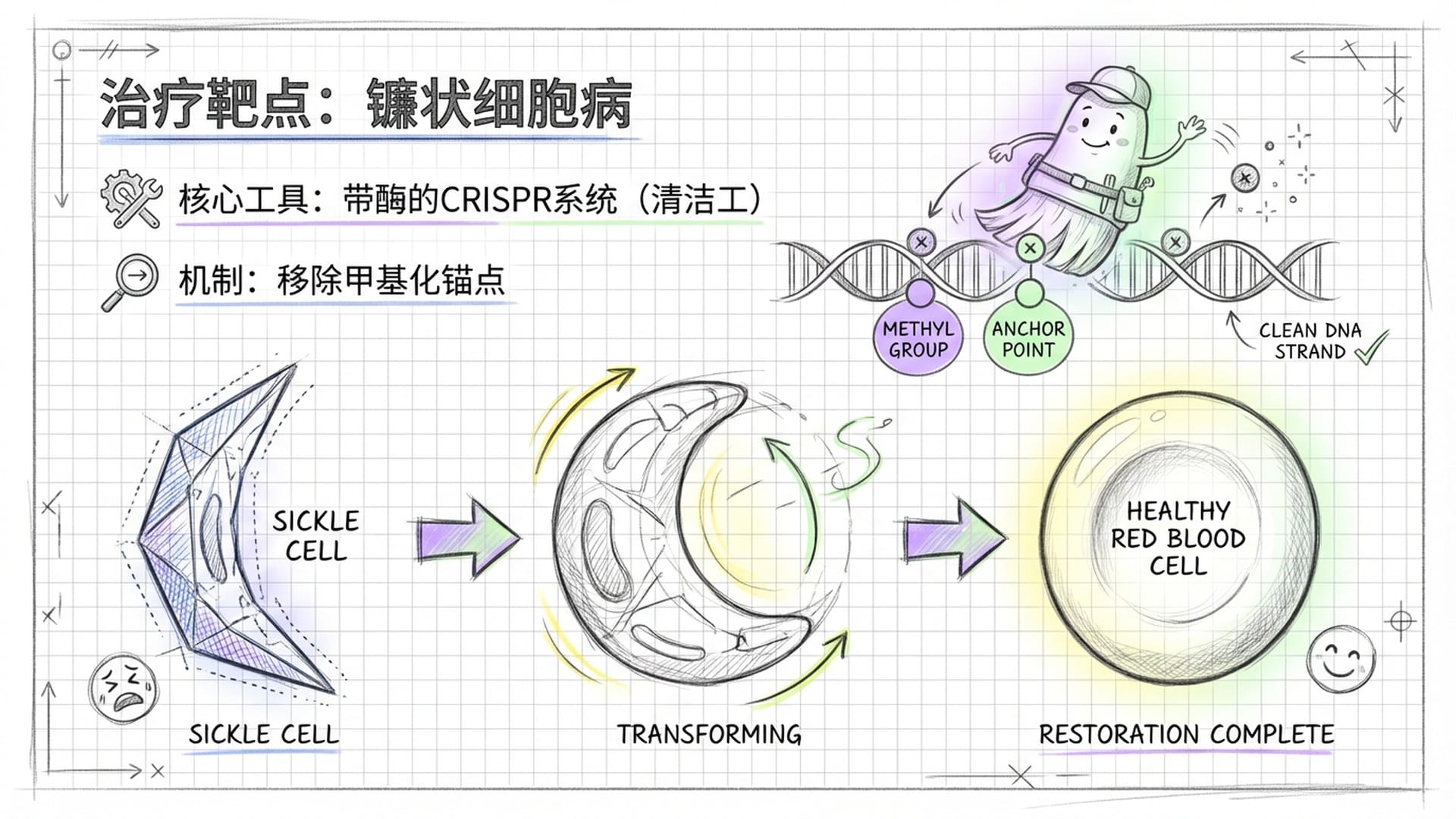
克罗斯利教授将胎儿血红蛋白基因比作**“小孩子自行车上的辅助轮”,通过新的技术,我们能让那些需要“新轮子”的人,重新让这个辅助轮转起来。这种“非代码修改,仅参数调整”**的策略,无疑预示着更加安全高效的基因治疗未来。
🔍 从实验室到临床:未来之路
目前,这项突破性研究仍在实验室阶段,在人类细胞上取得了显著成果。研究的合著者凯特·昆兰教授表示,这一发现不仅仅对镰状细胞病意义重大,对于其他许多可通过调整甲基基团来开启或关闭基因的遗传病,都拥有巨大的潜力。
“我们对表观遗传编辑的未来感到非常兴奋,因为我们的研究表明,它能让我在不修改DNA序列的情况下,提升基因表达。基于这项技术开发的疗法,相比于第一代或第二代CRISPR,发生意想不到负面影响的风险会大大降低。”
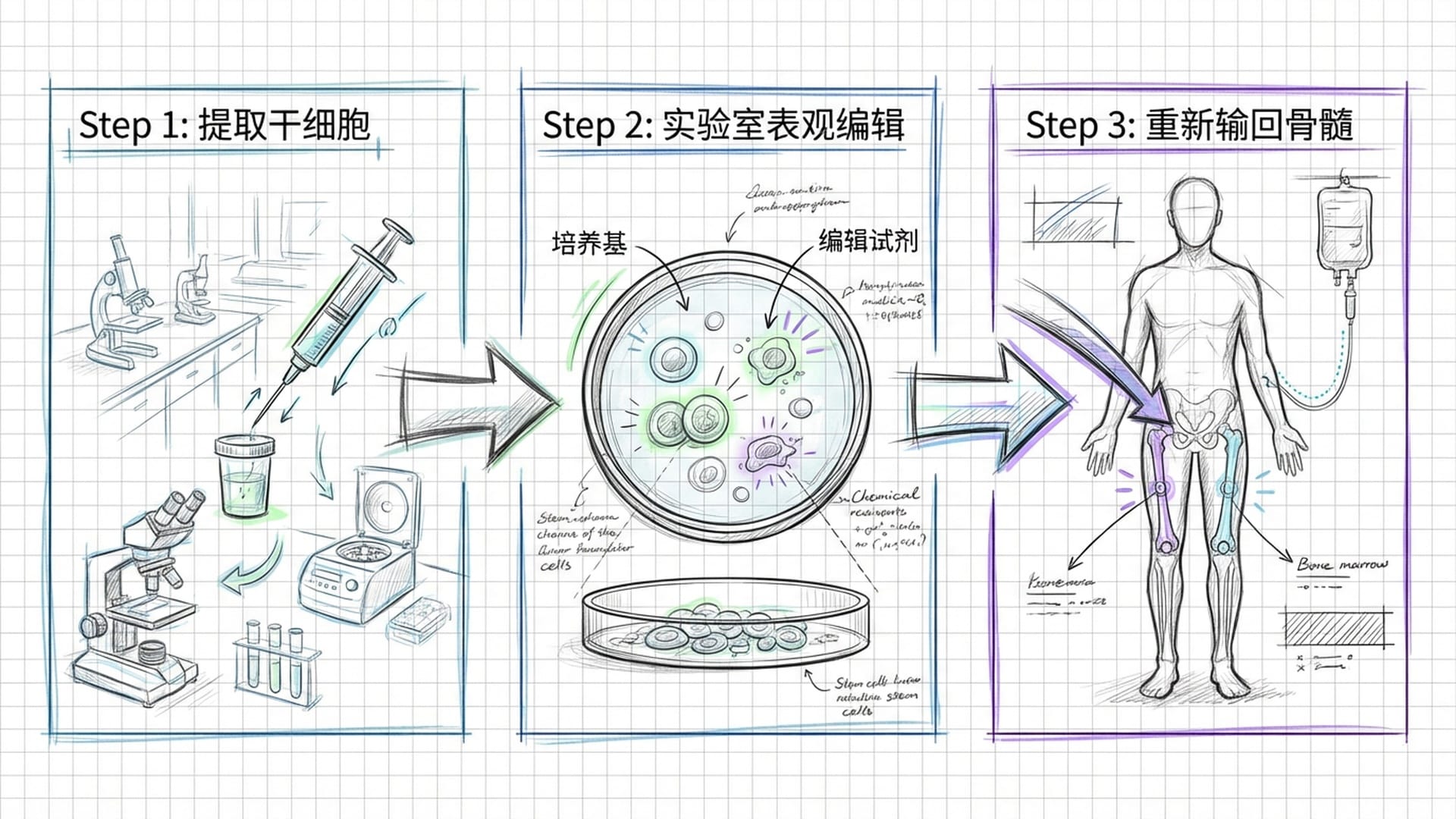
展望未来,一旦通过动物实验和临床试验的验证,这种新的治疗方法有望应用于镰状细胞病患者。治疗流程大致如下:
- 提取患者的血液干细胞:这些干细胞能够制造新的红细胞。
- 实验室编辑:利用表观遗传编辑技术,移除细胞中胎儿血红蛋白基因上的甲基化学标签,重新激活该基因。
- 回输患者体内:编辑后的细胞被重新输回患者体内,在骨髓中定居,并开始生产功能更优的血细胞。
整个过程**“没有刀光剑影,只有温柔的唤醒和修复”,听起来就像一场细胞的“升级改造”**。
尽管道路漫长,但新南威尔士大学和圣犹大的研究团队对此充满信心。克罗斯利教授强调:“我们在这里移除或添加甲基基团,但这仅仅是个开始。还有很多其他的改变我们可以做,这将大大增强我们改变基因输出的能力,无论是用于治疗还是农业用途。这仅仅是一个新时代的开端。”
“一个新时代的开端”,这不仅仅是一句展望,更是对生命科学无限可能的宣言。它意味着我们对生命的理解和干预,正迈向一个全新的维度。 CRISPR的这场**“不动刀”的温和革命**,将赋予我们“擦亮”生命潜能的力量,让生命的剧本变得更加精彩。
 |  |  |

